Ein neues theoretisch-wissenschaftliches Konzept ist eine innovative Herangehensweise an die Behandlung von Patientinnen und Patienten mit bestimmten Indikationen, die sich maßgeblich vom bereits existierenden Standard abgrenzt. Es ist ein Merkmal des, im Jahr 2016 eingeführten, Nutzenbewertungsverfahrens für Medizinprodukte hoher Risikoklassen gemäß § 137h Sozialgesetzbuch V (SGB).
Inhaltsverzeichnis
Hintergrund und gesetzliche Grundlage
Für das Nutzenbewertungsverfahren für Hochrisiko-Medizinprodukte wurden zahlreiche Kriterien festgelegt, aufgrund dessen eine Entscheidung zur Durchführung einer Nutzenbewertung gefällt werden kann. Grundsätzlich verankert sind die Regelungen zur Nutzenbewertung inkl. der Kriterien in § 137h SGB V – Bewertung neuer Untersuchungs- und Behandlungsmethoden (NUB) mit Medizinprodukten hoher Risikoklasse. Eine Definition für ein neues theoretisch-wissenschaftliches Konzept findet sich in § 137h Abs. 2 Satz 2 SGB V und darauf aufbauend in § 3 Medizinproduktemethodenbewertungsverordnung (MeMBV) sowie in § 31 Verfahrensordnung des Gemeinsamen Bundesausschusses (G-BA).
Definition „neues theoretisch-wissenschaftliches Konzept“
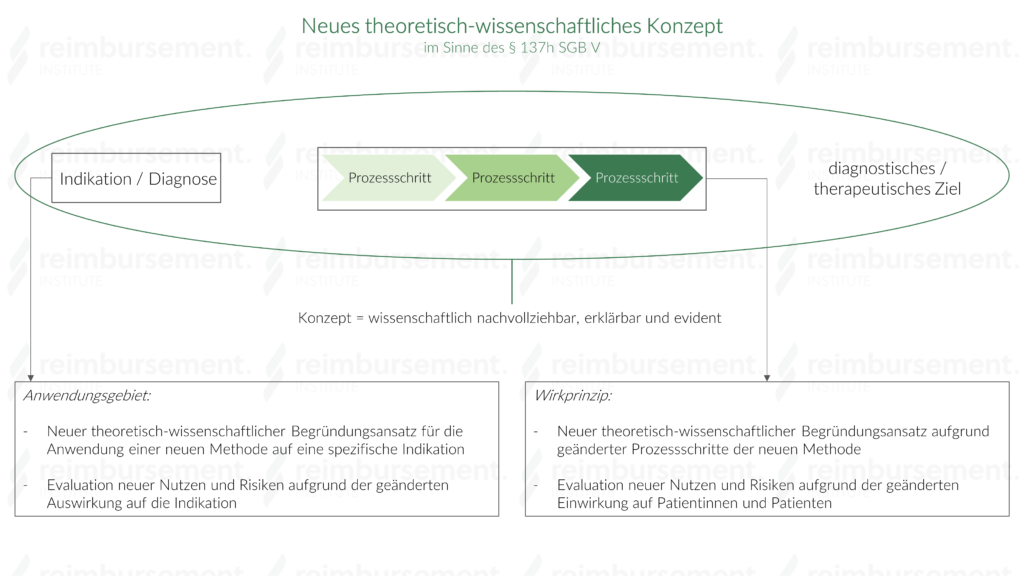
In § 137h Abs. 2 Satz 2 SGB V heißt es wortwörtlich, dass eine Methode ein neues theoretisch-wissenschaftliches Konzept aufweist, „wenn sich ihr Wirkprinzip oder ihr Anwendungsgebiet von anderen, in der stationären Versorgung bereits eingeführten systematischen Herangehensweise wesentlich unterscheidet“.
Für ein besseres Verständnis dieses Satzes bedarf es einer genaueren Betrachtung der einzelnen Begrifflichkeiten.
- Konzept
- Ein Konzept ist die Beschreibung einer systematischen Anwendung von Methoden (diagnostisch oder therapeutisch) auf Patientinnen und Patienten. Dabei werden verschiedene Prozessschritte (Wirkprinzip) durchgeführt, um diagnostische oder therapeutische Ziele in einer spezifischen Indikation (Anwendungsgebiet) zu erreichen und wissenschaftlich nachvollziehbar zu erklären.
- bereits in der stationären Versorgung eingeführte, systematische Herangehensweisen
- Bereits eingeführte Methoden sind solche, dessen Nutzen sowie etwaige Risiken bereits bekannt sind und in der stationären Versorgung eingesetzt werden. Bezogen auf die, im Jahr 2016 eingeführte, gesetzliche Regelung sind es zudem solche Methoden, die in der amtlichen Klassifikation der Operationen- und Prozedurenschlüssel (OPS) des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM – ehemals Deutschen Instituts für Medizinische Dokumentation und Information (DIMDI)) in der am 23. Juli 2015 geltenden Fassung inkludiert sind.
- Unterschied im Wirkprinzip
- Das Wirkprinzip einer neuen Methode unterscheidet sich wesentlich von bereits existierenden Methoden, wenn
- sich die Prozessschritte einer Methode geändert haben. Dies ist der Fall, wenn die Veränderung der Schritte derart different ist, sodass der theoretisch-wissenschaftliche Begründungsansatz bezüglich des diagnostischen oder therapeutischen Effekts neu verfasst werden muss.
- sich die Einwirkung der neuen Methode auf die Patientinnen und Patienten geändert hat. Dieser Fall liegt vor, wenn bereits vorhandene, evaluierte Nutzen und Risiken nicht auf die neue Methode übertragbar sind.
- Das Wirkprinzip einer neuen Methode unterscheidet sich wesentlich von bereits existierenden Methoden, wenn
- Unterschied im Anwendungsgebiet
- Das Anwendungsgebiet einer neuen Methode unterscheidet sich maßgeblich von bereits bestehenden Methoden, wenn
- ein neuer theoretisch-wissenschaftlicher Begründungsansatz verfasst werden muss. Dies ist dann gegeben, wenn die existierenden Begründungen den Einsatz der neuen Methode für eine spezifische Indikation nicht adäquat rechtfertigen können.
- sich die Auswirkung auf eine spezifische Indikation derart ändert, dass neue Nutzen und Risiken evaluiert werden müssen.
- Das Anwendungsgebiet einer neuen Methode unterscheidet sich maßgeblich von bereits bestehenden Methoden, wenn
Weitere, relevante Informationen:
- Arzneimittel
- Behandlungsfall
- BfArM – Bundesinstitut für Arzneimittel und Medizinprodukte
- DIMDI – Deutsches Institut für Medizinische Dokumentation und Information
- G-BA – Gemeinsamer Bundesausschuss
- Innovation
- Medizinprodukt
- NUB – Neue Untersuchungs- und Behandlungsmethoden
- Nutzenbewertungsverfahren für Medizinprodukte hoher Risikoklassen
- OPS – Operationen- und Prozedurenschlüssel
- SGB – Sozialgesetzbuch