Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) ist eine selbstständige Bundesbehörde im Geschäftsbereich des Bundesministeriums für Gesundheit (BMG). Das BfArM hat seinen Sitz in Bonn; seitdem wesentliche Funktionseinheiten des Deutschen Instituts für Medizinische Dokumentation und Information (DIMDI) am 26. Mai 2020 in das BfArM eingegliedert wurden, besitzt es zudem einen Dienstsitz in Köln.
Inhaltsverzeichnis
Historie zur Entstehung des BfArM
Am 24. August 1976 verabschiedete der damalige Bundestag das überarbeitete Gesetz über den Verkehr mit Arzneimitteln (Arzneimittelgesetz (AMG)), welches vollständig und final zum 01. Januar 1978 in Kraft trat. Mit der Überarbeitung des Gesetzes wurde ein bis heute zentraler und wesentlicher Aspekt für die Arzneimittelsicherheit eingeführt: ein gesetzlich vorgeschriebenes Zulassungsverfahren zum Nachweis von Qualität, Wirksamkeit und Unbedenklichkeit.
Im Zuge dessen entstand wenige Jahre zuvor das Institut für Arzneimittel als Teil des Bundesgesundheitsamtes (BGA). Nach seiner Auflösung am 24. Juni 1994 wurden gemäß BGA-Nachfolgegesetz (BGA-NachfG) stattdessen drei selbstständige Einrichtungen errichtet:
- das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), welches die Aufgabenbereiche des BGA übernahm,
- § 1 Abs. 1 BGA-NachfG: „Im Geschäftsbereich des Bundesministeriums für Gesundheit wird ein „Bundesinstitut für Arzneimittel und Medizinprodukte“ als selbständige Bundesoberbehörde errichtet.“
- das Robert-Koch-Institut (RKI),
- § 2 Abs. 1 BGA-NachfG: „Im Geschäftsbereich des Bundesministeriums für Gesundheit wird unter dem Namen „Robert Koch-Institut“ ein Bundesinstitut für Infektionskrankheiten und nicht übertragbare Krankheiten als selbständige Bundesoberbehörde errichtet.“
- das Bundesinstitut für gesundheitlichen Verbraucherschutz und Veterinärmedizin.
- ursprünglich § 3 BGA-NachfG, ist jedoch weggefallen
Seit dem Jahr 1994 fungiert das BfArM als selbstständige Bundesoberbehörde im Geschäftsbereich des Bundesministeriums für Gesundheit (BMG). Im Jahr 2020 sind zudem wesentliche Funktionseinheiten des DIMDI in das BfArM eingegliedert worden. Dies hatte zum Zweck, wichtige Ressourcen für die Arbeit im Arznei- und Medizinproduktebereich zu bündeln, um so schnell und flexibel auf die Entwicklungen im Gesundheitswesen reagieren zu können.
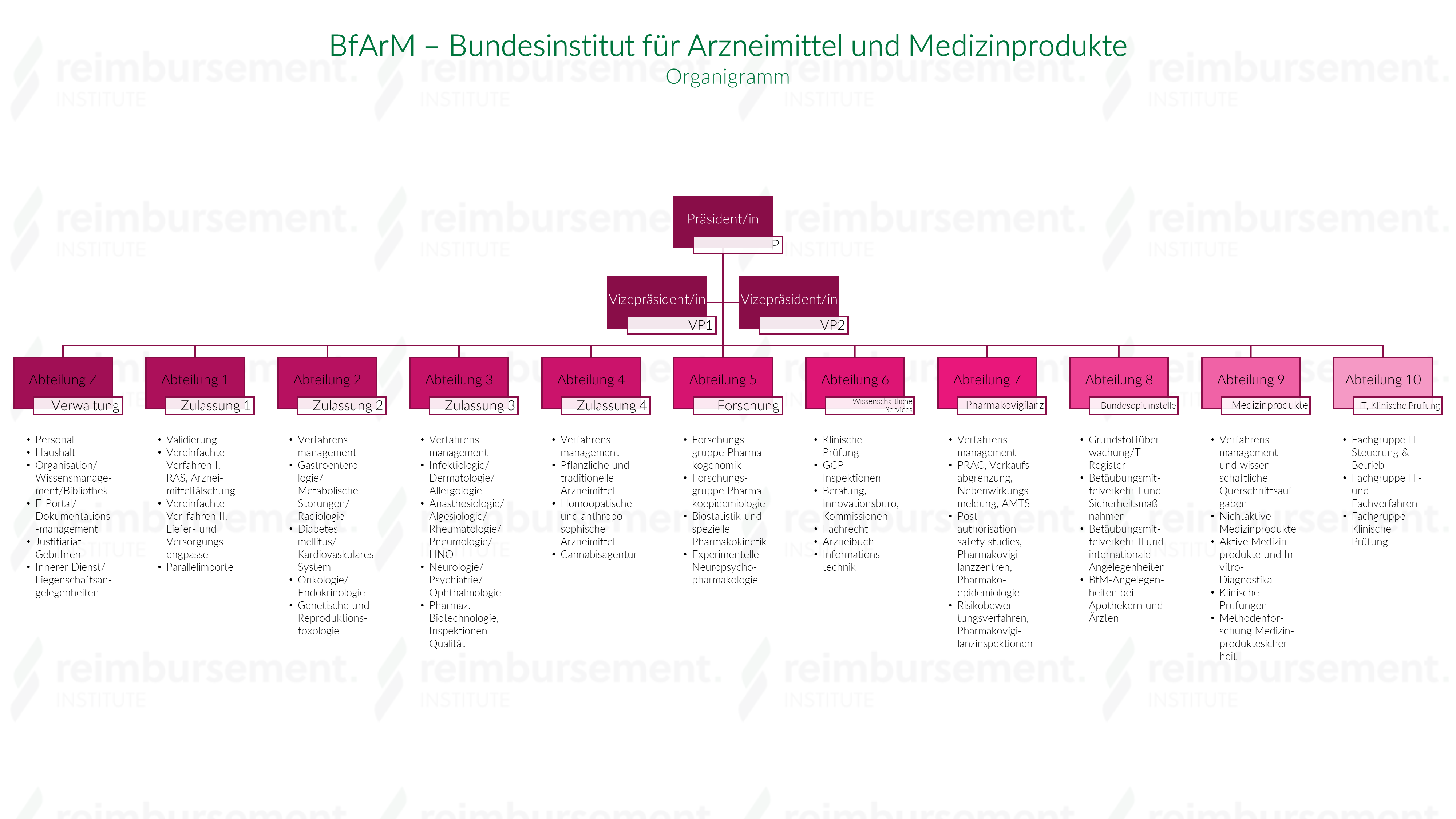
Aufbau
Das Institut wird geleitet von einem Präsidenten, dem der Vizepräsident nachgeordnet ist. Diesen beiden Positionen untergeordnet sind folgende Abteilungen:
- Abteilung Z – Verwaltung
- Abteilung K – Kodiersysteme und Register
- Abteilung 1 – Zulassung 1
- Abteilung 2 – Zulassung 2
- Abteilung 3 – Zulassung 3
- Abteilung 4 – Verfahrensmanagement
- Abteilung 5 – Forschung
- Abteilung 6 – Innovationsmanagement, Geschäftsstellen
- Abteilung 7 – Pharmakovigilanz
- Abteilung 8 – Bundesopiumstelle
- Abteilung 9 – Medizinprodukte
- Abteilung 10 – Informationstechnik, Klinische Prüfung
Weiterhin zugehörig sind die Bereiche Pressestelle, internationale Angelegenheiten, EU sowie weitere kleinere Bereiche.
Aufgaben
Gemäß § 1 Abs. 3 BGA-NachfG soll das BfArM insbesondere auf den nachfolgenden Gebieten tätig sein:
⇒ Forschung in verschiedenen Gebieten basierend auf den Hauptbereichen Zulassung und Überwachung von Arzneimitteln und Medizinprodukten (Abteilung 5)
- Fokus auf aktuelle Forschungsschwerpunkte bezüglich der Zulassung und Verbesserung der Sicherheit von Arzneimitteln
- Risikoerfassung und -bewertung bei Medizinprodukten
- Entwicklung regulatorischer Expertise
⇒ Informationssystem Arzneimittel und Medizinprodukte (Abteilung 10)
- Öffentliche Datenbank zu Arzneimitteln und Versandhandelsregister
- Unterstützung der zentralen Marktüberwachung von Medizinprodukten durch Betrieb eines Informationssystems gemäß § 33 Medizinproduktegesetz (MPG)
- Bereich des ehemaligen DIMDI
- Herausgabe von Klassifikationen, Terminologien und Standards im Gesundheitswesen (u.a. International Classification of Diseases (ICD-10-GM); Operationen- und Prozedurenschlüssel (OPS))
- Bereich des ehemaligen DIMDI
Arzneimittel
⇒ Zulassung von Fertigarzneimitteln auf Grundlage des Arzneimittelgesetzes (AMG; Abteilungen 1 bis 4)
- Prüfung des gesundheitlichen Nutzens (Wirksamkeit, Unbedenklichkeit, pharmazeutische Qualität) des Arzneimittels
- Aufgabenerfüllung bei der europäischen Zulassung
- Überprüfung und Zulassung von Humanarzneimitteln
- Bearbeitung von Anträgen zur Verlängerung der Arzneimittelzulassung
⇒ Registrierung und Zulassung homöopathischer Arzneimittel (Abteilung 4)
- Registrierung homöopathischer Arzneimittel ohne Anwendungsgebiete
- Zulassung ebendieser Arzneimittel mit Anwendungsgebieten
⇒ Überwachung der Arzneimittelsicherheit ((Pharmakovigilanz; Abteilung 7)
- Sammlung und Bewertung von Informationen über bekannt gewordene Neben- und Wechselwirkungen von Arzneimitteln
- Entscheidung über und Koordination von Maßnahmen zur Gefahrenabwehr
⇒ Überwachung des Verkehrs mit Betäubungsmitteln und Grundstoffen durch die Bundesopiumstelle ((BOPST; Abteilung 8)
- Überwachung und Erteilung von Erlaubnissen zur Teilnahme am Betäubungsmittel- und Grundstoffverkehrs
- Erteilung von Ein- und Ausfuhrgenehmigungen
- Herausgabe von amtlichen Formblättern zur Verschreibung von Betäubungsmitteln
- …
Medizinprodukte
⇒ Risikoerfassung und -bewertung sowie Durchführung von Maßnahmen nach dem Stufenplan
⇒ Arbeiten zur medizinischen und technischen Sicherheit, Eignung und Leistung von Medizinprodukten
⇒ Zentrale Risikoerfassung sowie Durchführung von Maßnahmen zur Risikoabwehr bei Medizinprodukten (Abteilung 9)
- Bewertung von Vorkommnismeldungen (Produktmängel, negative Ereignisse mit Medizinprodukten)
- Herausgabe von Empfehlungen an Hersteller zur Überprüfung gemeldeter Medizinprodukte und zur Änderung der Produkte
- Vergabe von Genehmigungen zu klinischen Prüfungen