Das Paul-Ehrlich-Institut (PEI) gilt als Bundesinstitut, das seit 1990 mit Sitz in Langen (Südhessen) für Impfstoffe und biomedizinische Pharmazeutika zuständig ist. Die Tätigkeit des PEI beruft sich auf den Arzneimittelbereich und die Gesundheit – Kernaufgaben werden im Bereich der „Public Health“ erbracht.
Inhaltsverzeichnis
Historie zur Entstehung des PEI
Die ursprüngliche Prüfungs- und Forschungsstätte wurde am 01. Juni 1896 als „Institut Serumforschung und Serumprüfung“ in Steglitz gegründet. Erster Direktor und Mitbegründer des Instituts war Paul Ehrlich, ein Immunologe, Wissenschaftler und Nobelpreisträger, der im August 1915 verstarb. Im Jahr 1947 bewirkte ein Enkel Paul Ehrlichs schließlich die Umbenennung des Instituts in das „Paul-Ehrlich-Institut“, dessen Namen es bis heute trägt. Im Jahr 1972 wurde das PEI zu einer selbständigen Bundesoberbehörde durch das Gesetz zur Errichtung eines Bundesamtes für Sera und Impfstoffe. Seit dem Jahr 2005 gilt das PEI als WHO-Kooperationszentrum unter besonderer Aufgabe der Qualitätssicherung von Blutprodukten und In-vitro-Diagnostika (IVD). Im Jahr 2013 erfolgte hinzukommend die Ernennung des WHO-Kooperationszentrums für Impfstoffe. Am Standort des PEI sind demnach zwei Kooperationszentren der Weltgesundheitsorganisation (WHO) niedergelassen.
Seither ist das PEI in ein nationales sowie internationales Netzwerk integriert und kooperiert mit verschiedenen Partnern. Auf internationaler Ebene arbeitet das Institut unter anderem mit der Europäischen Arzneimittelagentur (European Medicines Agency – EMA), den Leitern der Zulassungsbehörde für Human- und Tierarzneimittel (Heads of Medicines Agencies – HMA) sowie dem Europäischen Direktorat für die Qualität von Arzneimitteln (European Directorate for the Quality of Medicines and Healthcare – EDQM) zusammen.
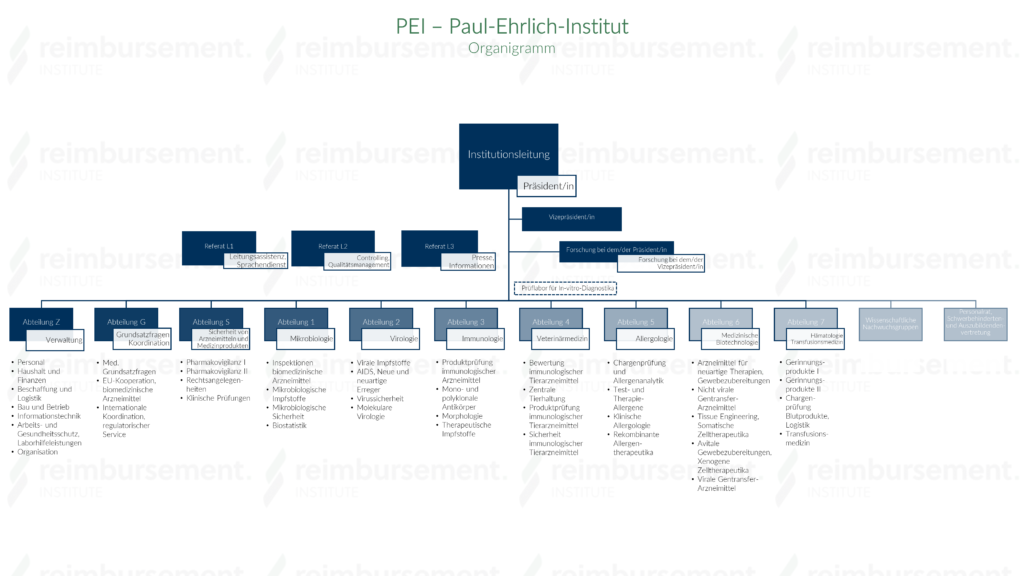
Aufbau
Das Paul-Ehrlich-Institut wird von einem/einer Präsidenten/in geleitet, dem/der ein(e) Vizepräsident/in untergeordnet ist. Für beide Positionen stehen eigene Forschungsteams sowie drei Referatsgruppen zur Verfügung.
Untergeordnet sind folgende Abteilungen:
- Abteilung Z – Verwaltung
- Abteilung G – Grundsatzfragen, Koordination
- Abteilung S – Sicherheit von Arzneimitteln und Medizinprodukten
- Abteilung 1 – Mikrobiologie
- Abteilung 2 – Virologie
- Abteilung 3 – Immunologie
- Abteilung 4 – Veterinärmedizin
- Abteilung 5 – Allergologie
- Abteilung 6 – Medizinische Biotechnologie
- Abteilung 7 – Hämatologie, Transfusionsmedizin
- Wissenschaftliche Nachwuchsgruppen
- Personalrat, Schwerbehinderten- und Auszubildendenvertretung
Aufgaben
Als Bundesbehörde im Dienst des Bundesministeriums für Gesundheit (BMG) ist das Paul-Ehrlich-Institut zuständig für die Überprüfung und Nutzen-Risiko-Bewertung von biomedizinischen Human-Arzneimitteln sowie immunologischen Tier-Arzneimitteln. Zudem fokussiert sich das Institut auf die eigene (Er-)Forschung im Bereich der Immunologie. Der Schwerpunkt liegt auf der eigenen experimentellen Forschung. Dazu wurde dem PEI im Jahr 2000 eine herausgehobene Position durch den Wissenschaftsrat erteilt. Zudem liegen weitere Kernaufgaben bei der Zulassung biomedizinischer Human-Arzneimittel und von Impfstoffen.
Zahlreiche Arzneimittel sowie Stoffe, wie beispielsweise Impfstoffe, xenogene und somatische Zelltherapeutika und Arzneimittel für neuartige Therapien (z. B. Gentherapeutika), Allergene, Blutprodukte sowie Gewebezubereitungen unterliegen der Bewertung durch das PEI. Die Bewertung erfolgt insbesondere für Antikörperbehandlungen schwerwiegender Erkrankungen, wie Autoimmunerkrankungen oder Krebs.
Historisch gewachsen sind weitere Zuständigkeitsbereiche, zum einen durch die Errichtung einer Abteilung Medizinischer Biotechnologie sowie durch die Abteilung für Hämatologie und Transfusionsmedizin. Zudem wurde dem PEI die Zuständigkeit für Blut und Blutzubereitungen zugetragen, wofür ehemals das Bundesgesundheitsamt zuständig war.
Unter Berücksichtigung der Sicherstellung eines positiven Nutzen-Risiko-Verhältnisses biomedizinischer Arzneimittel des deutschen sowie europäischen Marktes, geht das Institut mit seinen über 900 Mitarbeiterinnen und Mitarbeitern verschiedenen Aufgaben nach:
- unabhängige, staatliche sowie experimentelle Prüfung und Freigabe von Chargen
- Forschung, insbesondere die Grundlagenforschung um neuartige Behandlungsansätze zu entwickeln
- Nebenwirkungen bewerten (Pharmakovigilanz)
- klinische Prüfungen genehmigen
- Beratung von Vertretern aus Politik und Öffentlichkeit
- Sicherstellung der Verhütung einer gesundheitlichen Gefährdung von Mensch und Tier