Die European Medicines Agency (EMA) wurde 1995 gegründet und hat ihren Sitz in London. Als europäische Arzneimittelagentur ist sie zuständig für die zentrale Arzneimittelzulassung in Europa. Ihr Fokus liegt auf dem Schutz und der Förderung der Gesundheit der Bevölkerung sowie der Tierwelt, basierend auf der Beurteilung und Überwachung von Human- und Tierarzneimitteln.
Inhaltsverzeichnis
Historie zur Entstehung der EMA
Die EMA wurde 1995 gegründet, um zunächst die Arbeit der bestehenden nationalen Arzneimittelaufsichtsbehörden zu harmonisieren. Durch sich erweiternde EU-Rechtsvorschriften kamen im Laufe der Zeit neue Aufgabenbereiche hinzu. Seit dem Jahr 2000 ist die EMA für Produkte aus dem Spezialgebiet der seltenen Krankheiten verantwortlich. Als Konsequenz daraus resultierte der Ausschuss für Arzneimittel für seltene Leiden, deren Vertreter aus Patienten und Angehörigen von Gesundheitsberufen bestehen. Im Jahr 2004 kamen die Produkte basierend auf pflanzlichen Arzneimitteln hinzu, im Jahr 2006 dann die Arzneimittel für Kinder. Im Jahr 2007 wurde der Verantwortungsbereich zusätzlich um Fortgeschrittene Therapiemedikamente ergänzt. Alle Schwerpunkterweiterungen hatten zur Folge, dass entsprechende neue wissenschaftliche Ausschüsse für die genannten Fachbereiche implementiert wurden.
Herauszustellen ist außerdem die Einrichtung des Ausschusses für Pharmakovigilanz im Jahr 2012. Dieser ist seither für die Überwachung der Sicherheit von Arzneimitteln in ganz Europa zuständig. Seit dem Jahr 2015 fokussiert sich die EMA zudem auf die Veröffentlichung klinischer Daten, die der europäischen Entscheidungsfindung in Bezug auf Arzneimitteln zugrunde liegen. Somit wird ein hohes Maß an Transparenz gewährleistet.
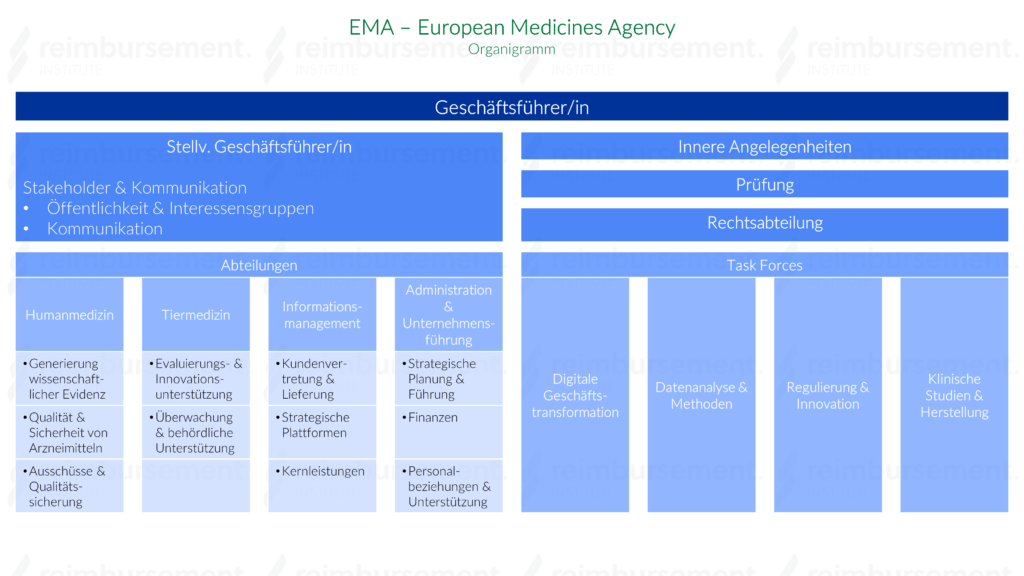
Aufbau
Die Europäische Arzneimittel-Agentur ist eine dezentrale Agentur der Europäischen Union (EU), die für die wissenschaftliche Bewertung, Überwachung und Sicherheitsüberwachung von Arzneimitteln in der EU zuständig ist.
Sie wird von einem unabhängigen Vorstand geleitet. Die laufenden Geschäfte werden von den EMA-Mitarbeitern durchgeführt, die vom/von der Geschäftsführer/in der EMA beaufsichtigt werden. Der Vorstand besteht aus 36 Mitgliedern, die im öffentlichen Interesse tätig sind und keine Regierung, Organisation oder Branche vertreten. Der Verwaltungsrat legt das Budget der Agentur fest, genehmigt das jährliche Arbeitsprogramm und ist dafür verantwortlich, dass die Agentur effektiv arbeitet und erfolgreich mit Partnerorganisationen in der gesamten EU und darüber hinaus kooperiert. Der/Die Geschäftsführer/in der Agentur ist der/die gesetzliche Vertreter/in der Agentur. Er/Sie ist verantwortlich für alle betrieblichen Angelegenheiten, Personalfragen und die Erstellung des jährlichen Arbeitsprogramms.
Die Mitarbeiter der Agentur unterstützen den/die Geschäftsführer/in bei der Wahrnehmung seiner/ihrer Aufgaben, einschließlich administrativer und verfahrenstechnischer Aspekte des EU-Rechts im Zusammenhang mit der Bewertung und Sicherheitsüberwachung von Arzneimitteln in der EU.
Die EMA verfügt zudem über sieben wissenschaftliche Komitees, die Arzneimittel entlang ihres Lebenszyklus von frühen Entwicklungsstadien über die Genehmigung für das Inverkehrbringen bis hin zur Sicherheitsüberwachung bewerten, sobald sie auf dem Markt sind. Darüber hinaus verfügt die Agentur über eine Reihe von Arbeitsgruppen und verwandten Gruppen, die die Ausschüsse zu wissenschaftlichen Fragen im Zusammenhang mit ihrem jeweiligen Fachgebiet konsultieren können.
Aufgaben
- Erstellen von unabhängigen, wissenschaftlich fundierten Empfehlungen und Leitlinien für die Qualität, Sicherheit und Wirksamkeit von Arzneimitteln
- Anwendung effizienter und transparenter Bewertungsverfahren, um die Markteinführung neuer Medikamente mit Hilfe eines, von der Europäischen Kommission anerkannten Zulassungsverfahrens zu gewähren
- Durchführung von Maßnahmen zur kontinuierlichen Überwachung der Qualität, Sicherheit und Wirksamkeit zugelassener Arzneimittel (Vorteil > Risiko)
- Beratung zur Förderung der Entwicklung und zur Verbesserung der Verfügbarkeit innovativer Arzneimittel
- Empfehlungen über Grenzwerte von Tierarzneimittel-Rückständen in Tieren, die zur Nahrungsmittelerzeugung genutzt werden
- Förderung des Dialogs zwischen Patienten, Berufszugehörigen oder anderen Interessengruppen
- Veröffentlichung relevanter Informationen bezüglich der Arzneimittel und deren Verwendung
- Entwicklung von Methoden zur Beurteilung von Arzneimitteln und Erarbeiten von Standards, die über die Grenzen Europas gültig sind
Um die Erfüllung dieser Aufgaben zu gewährleisten, kooperiert die EMA mit verschiedenen Partnern aus der pharmazeutischen Industrie, der Gruppe von Patienten und Verbrauchern und anderer europäischer Organisationen.