Zwar bilden randomisierte kontrollierte Studien (RCTs) den Goldstandard, um medizinische Therapien einschätzen und bewerten zu können. Jedoch kann selbst eine vollständig und korrekt durchgeführte RCT nicht richtig verstanden oder fehlinterpretiert werden. Dieser Umstand wird durch die Beschreibung der Studie durch den Studienautor begünstigt. Der Autor trägt wesentlich dazu bei, dass der Leser einen vollständigen, objektiven und transparenten Eindruck der Studie erhält. Andernfalls können Studien, zum Beispiel hinsichtlich der Wirksamkeit von Interventionen, falsch oder gar nicht erst interpretiert werden.
Vor diesem Hintergrund haben sich Mitte der 90er Jahre klinische Forscher, Statistiker, Epidemiologen und Herausgeber aus dem biomedizinischen Bereich zusammengefunden und das CONSORT Statement verfasst, das zu einer klaren, transparenten und vollständigen Beschreibung von randomisierten Studien jeglicher Art beitragen soll. CONSORT steht dabei für „Consolidated Statement of Reporting Trials“. Der Schwerpunkt dieses Statements liegt jedoch auf der Bewertung von individuell randomisierten Parallelvergleichen zweier Gruppen und deckt damit das am häufigsten verwendete Studiendesign ab. Dabei distanziert man sich von einer standardisierten Darstellung der Studienberichte und legt den Fokus vielmehr auf inhaltliche Aspekte.
Wichtig ist an dieser Stelle, dass man ganz klar zwischen einer unzureichenden Berichterstattung und der Verzerrung der Studienergebnisse durch sog. Bias unterscheidet.
Zwar lässt sich mutmaßen, dass eine unzureichende Berichterstattung auf Bias zurückzuführen ist, dennoch gilt es diesen Zusammenhang zu hinterfragen. Eine Studie mit hohem Verzerrungspotenzial kann trotzdem eine hohe Berichtsqualität aufweisen, sofern potenzielle Fehler transparent, objektiv und hinreichend beschrieben werden. Es ist nicht das Ziel des CONSORT Statements die Studie selbst zu verbessern, sondern lediglich die Berichterstattung zur Studie.
So wurde 1996 die erste Leitlinie für die Bewertung von Studienberichten zu RCTs herausgegeben und 2010 zuletzt aktualisiert. Das CONSORT 2010 Statement umfasst ein Flussdiagramm und eine Checkliste mit 25 Punkten. Zu dieser Checkliste wurde ebenfalls ein Dokument verfasst, das wichtige Erläuterungen zu den einzelnen Punkten liefert.
Inhaltsverzeichnis
CONSORT-Flussdiagramm
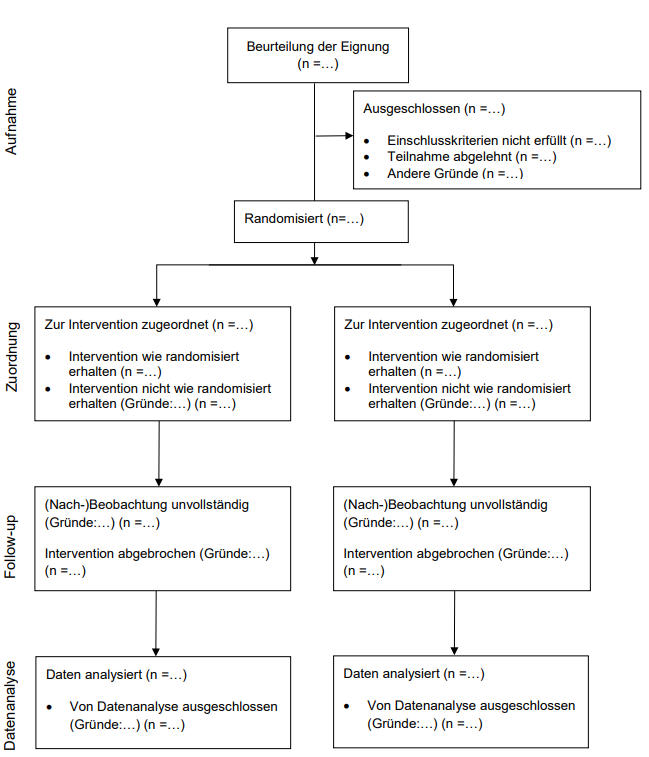
Das CONSORT-Flussdiagramm dient der Dokumentation der ein- und ausgeschlossenen Teilnehmerzahl während der verschiedenen Phasen einer zweiarmigen randomisierten klinischen Studie. So kann von der Aufnahme bis zur Datenanalyse nachvollzogen werden, in welchem Arm und in welcher Anzahl Teilnehmer aus der Studie ausgeschieden sind. Ebenfalls können Gründe für das Ausscheiden aus der Studie genannt werden. Das vollständig ins Deutsche übersetzte Flussdiagramm kann in der nachfolgenden Abbildung 1 eingesehen werden.
Checkliste
Das CONSORT Statement beinhaltet neben dem Flussdiagramm auch eine Checkliste mit derzeit 25 Punkten, die in sich zum Teil weiter ausdifferenziert werden. Diese Checkliste dient dazu, herauszufinden, welche Informationen ein Bericht über eine randomisierte Studie enthält und an welcher Stelle Lücken in der Berichterstattung oder evtl. sogar innerhalb der Forschung existieren.
Die Checkliste lässt sich grob in mehrere Abschnitte gliedern. So bewertet der erste Abschnitt der Checkliste den Titel und die Zusammenfassung der Studie. Darauf folgt in jeweils neuen Abschnitten die Bewertung der Einleitung und der zugrundeliegenden Methoden. Die Methodenbewertung findet anhand mehrerer Unterpunkte wie zum Beispiel dem Studiendesign oder relevanter Endpunkte statt. Das nächste Kapitel bilden Unterpunkte innerhalb der Randomisierung, in dem vermerkt werden soll, ob und wie der Autor beispielsweise die Verblindung und statistische Methoden beschreibt. Die letzten drei Abschnitte kennzeichnen den Schlussteil einer jeden Studie. Auf den Abschnitt der Ergebnisse folgen die Diskussion und andere Informationen, in denen zum Beispiel Patientencharakteristika, Limitierungen und die Finanzierung angesprochen werden.
Je mehr Aspekte der Checkliste in der Studie wiedergefunden werden, desto eher kann der Leser die Relevanz und Ergebnisse der Studie beurteilen, unabhängig davon, ob es sich bereits um den Goldstandard einer randomisierten kontrollierte Studie handelt oder nicht. Nachfolgend zeigt Abbildung die ins Deutsche übersetzte Checkliste.
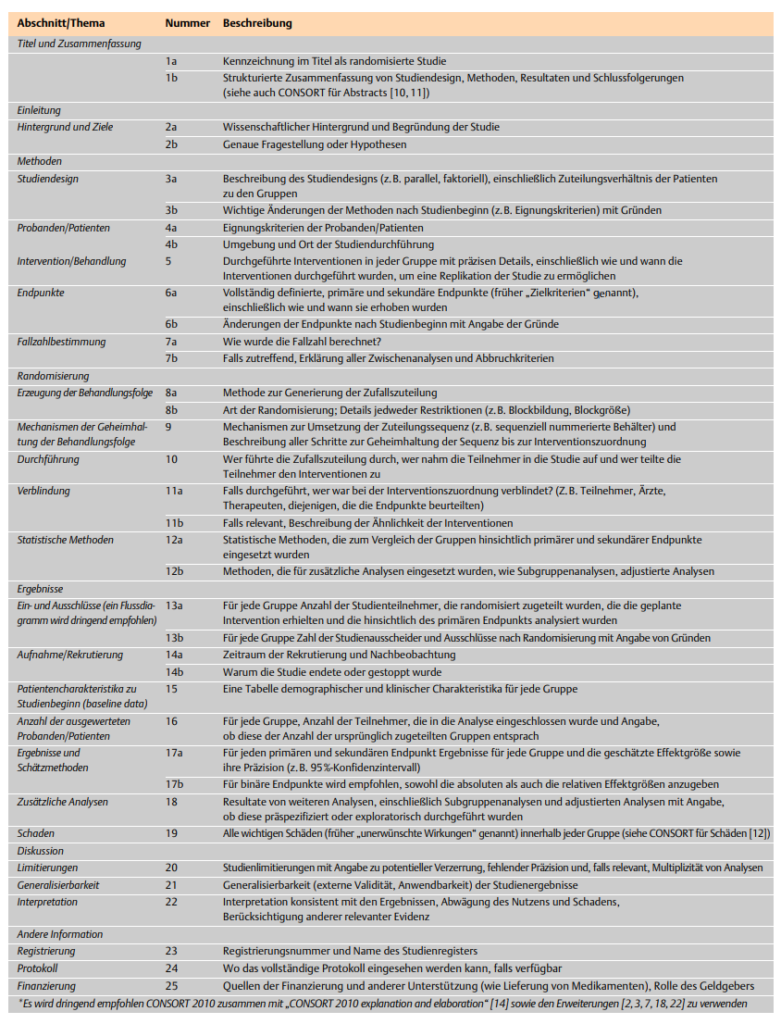
CONSORT Checkliste (Quelle: Deutsche Medizinische Wochenschrift in Anlehnung an CONSORT 2010 Statement)