Das Arzneimittelgesetz (AMG), oder auch das Gesetz über den Verkehr mit Arzneimitteln, wurde mit dem Zweck eingeführt, „im Interesse einer ordnungsgemäßen Versorgung der Bevölkerung mit Arzneimitteln für die Sicherheit im Verkehr mit Arzneimitteln, insbesondere für die Qualität, Wirksamkeit und Unbedenklichkeit der Arzneimittel nach Maßgabe der folgenden Vorschriften zu sorgen“ (§ 1 AMG). Mit Inkrafttreten des Tierarzneimittelgesetzes (TAMG) am 28. Januar 2022 ist das AMG nicht mehr auf Tiere, sondern ausschließlich auf den menschlichen Körper anzuwenden.
Inhaltsverzeichnis
Historie
Arzneimittelgesetz von 1961
Am 16. Mai 1961 führte Deutschland das Arzneimittelgesetz als letztes EWG-Mitglied (Europäische Wirtschaftsgemeinschaft) im Zuge der Implementierung eines Gesundheitsministeriums ein. Es sah zunächst nur eine Registrierung von Arzneimitteln vor, nicht aber eine Verpflichtung zur Prüfung von Wirksamkeit und Sicherheit. Gemäß § 20 Abs. 1 AMG (von 1961) durften Arzneimittel demnach in Verkehr gebracht werden, „nachdem sie in ein bei dem Bundesgesundheitsamt zu führendes Register (Spezialitätenregister) eingetragen“ wurden. Lediglich Arzneimittel, „die wegen ihrer nicht vermeidbaren ungleichmäßigen Zusammensetzung oder wegen Schwankungen ihres Wirkstoffgehalts besondere gesundheitliche Gefahren in sich [bargen]“ (§ 27 AMG (von 1961) konnten nach Anordnung durch den Bundesminister des Innern einer staatlichen Prüfung unterzogen werden.
Arzneimittel zur Abgabe an den Verbraucher mussten zudem den Vorschriften des Arzneibuches entsprechen. Hersteller, die eine Erlaubnis zur gewerbsmäßigen Herstellung von Arzneimitteln sowie Herstellung von Sera, Impfstoffen oder Blut- und Serumkonserven besaßen, waren jedoch nicht an diese Vorgaben gebunden.
Im Laufe der Zeit wurden die Forderungen nach einer Verbesserung der Arzneimittelsicherheit jedoch immer größer, weshalb es 1976 zur Implementierung eines neuen, überarbeiteten und erweiterten AMG kam.
Arzneimittelgesetz von 1976, Neufassung 2005, zuletzt geändert 2024
Der Bundestag von 1976 beschloss am 24. August 1976 mit Zustimmung des Bundesrates das überarbeitete Gesetz über den Verkehr mit Arzneimitteln. Mit Ausnahme des § 78 (Preise) ist es am 01. Januar 1978 in Kraft getreten.
Seit Inkrafttreten des Gesetzes hat es zum Zweck, für die Sicherheit im Verkehr mit Arzneimitteln, insbesondere für die Qualität, Wirksamkeit und Unbedenklichkeit der Arzneimittel nach Maßgabe von Vorschriften unter Berücksichtigung einer ordnungsgemäßen Arzneimittelversorgung von Mensch und Tier zu sorgen.
Die wesentliche Änderung in dem neuen AMG ist die Einführung eines gesetzlich vorgeschriebenen Zulassungsverfahrens mit dem Nachweis von Qualität, Wirksamkeit und Unbedenklichkeit. Verankert in § 21 Abs. 1 AMG wird vorgeschrieben, dass „Fertigarzneimittel […] im Geltungsbereich dieses Gesetzes nur in den Verkehr gebracht werden [dürfen], wenn sie durch die zuständige Bundesoberbehörde zugelassen sind oder wenn für sie die Europäische Gemeinschaft oder die Europäische Union eine Genehmigung für das Inverkehrbringen […] erteilt hat“. In Deutschland erfolgt die Zulassung durch das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), bei Blut und Blutprodukten durch das Paul-Ehrlich-Institut (PEI).
Durch den medizinischen Fortschritt und die Harmonisierung des Arzneimittelrechts in der Europäischen Union sind in den vergangenen Jahrzehnten diverse Novellen in Kraft getreten, um das Gesetz an die sich ändernden Gegebenheiten anzupassen. Die letzte AMG-Novelle (16. AMG-Novelle – Zulassung von Arzneimitteln, Pharmakovigilanz und Therapiefreiheit) ist am 01. April 2014 in Kraft getreten. Ziel dieser Novelle war die Minimierung des Antibiotika-Einsatzes in der Nutztierhaltung. Das Jahr 2022 ging mit der 17. Novelle einher und hatte zur Folge, dass der Geltungsbereich des AMG keine Tiere oder die Tierhaltung mehr umfasst. Alle damit verbundenen Paragraphen des AMG (bspw. §§ 56 bis 61) wurden infolgedessen aufgehoben. Regelungen für Tierarzneimittel sind seither im Gesetz über den Verkehr mit Tierarzneimitteln und zur Durchführung unionsrechtlicher Vorschriften betreffend Tierarzneimittel (Tierarzneimittelgesetz – TAMG) zu finden.
Das Wirksamwerden des Medizinforschungsgesetzes vom 23. Oktober 2024 hatte ebenfalls Auswirkungen auf das AMG. Vier neue Paragraphen wurden dem Arzneimittelgesetz hinzugefügt und regeln seitdem die Schaffung eines indikationsbezogenen Registers für Arzneimittel (§ 4c), die Richtlinien zur Bewertung klinischer Prüfungen durch Ethik-Kommissionen (§ 41d), die Standardvertragsklauseln für die Durchführung klinischer Prüfungen (§ 42d) sowie die Empfehlungen für von nichtkommerziellen Sponsoren durchgeführte klinische Prüfungen ohne wirtschaftliche Zwecksetzung (§ 42e).
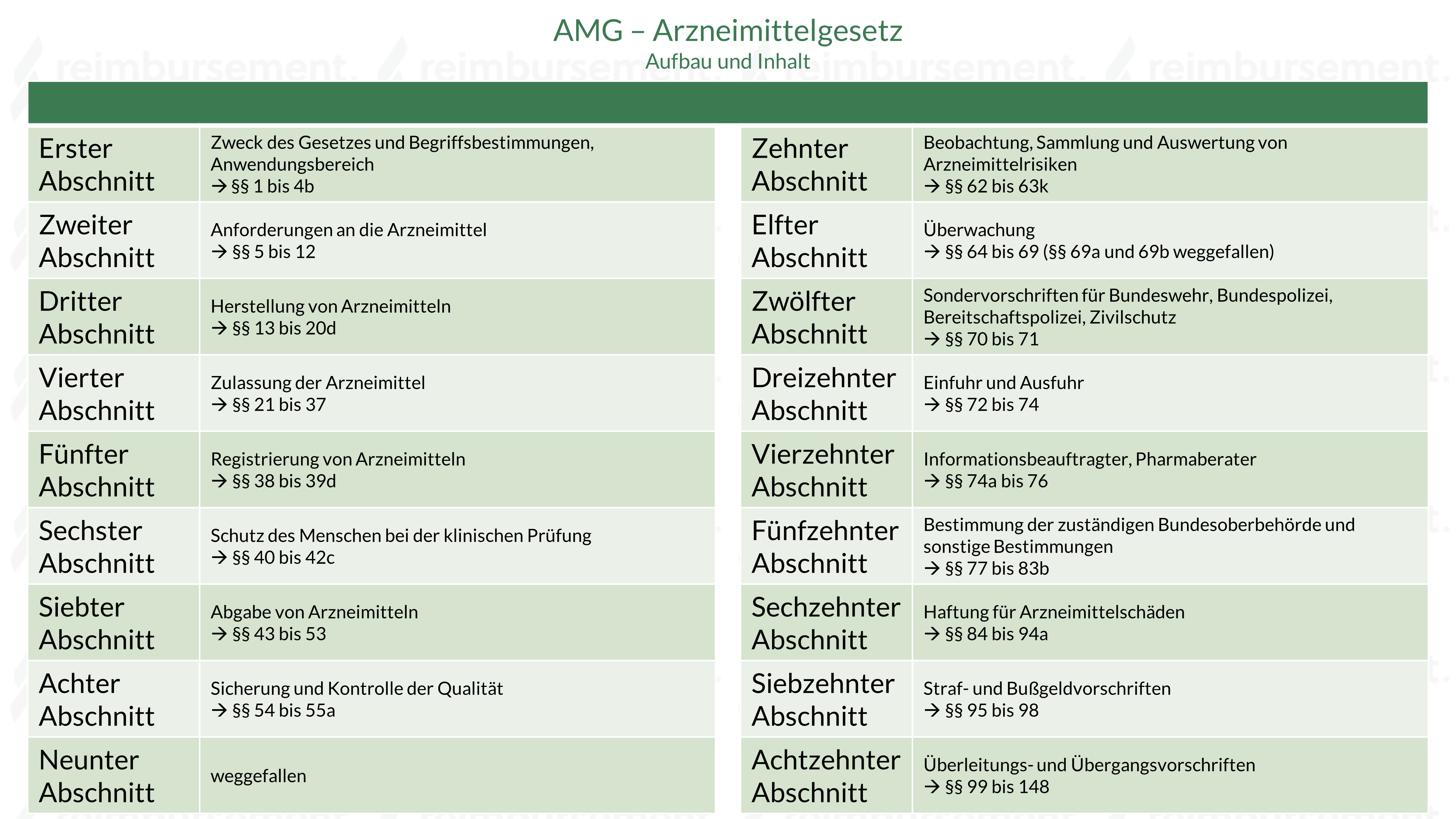
Aufbau und Inhalt
Das AMG ist unterteilt in insgesamt 18 Abschnitte, mit unterschiedlichen thematischen Schwerpunkten:
- Abschnitt – Zweck des Gesetzes und Begriffsbestimmungen, Anwendungsbereich
- §§ 1 bis 4c
- Abschnitt – Anforderungen an die Arzneimittel
- §§ 5 bis 12
- Abschnitt – Herstellung von Arzneimitteln
- §§ 13 bis 20d
- Abschnitt – Zulassung der Arzneimittel
- §§ 21 bis 37
- Abschnitt – Registrierung von Arzneimitteln
- §§ 38 bis 39d
- Abschnitt – Schutz des Menschen bei der klinischen Prüfung
- §§ 40 bis 42e
- Abschnitt – Abgabe von Arzneimitteln
- §§ 43 bis 53
- Abschnitt – Sicherung und Kontrolle der Qualität
- §§ 54 bis 55a
- Abschnitt – (weggefallen)
- §§ 56 bis 61 (aufgehoben)
- Abschnitt – Beobachtung, Sammlung und Auswertung von Arzneimittelrisiken
- §§ 62 bis 63k
- Abschnitt – Überwachung
- §§ 64 bis 69 (§§ 69a und b aufgehoben)
- Abschnitt – Sondervorschriften für Bundeswehr, Bundespolizei, Bereitschaftspolizei, Zivilschutz
- §§ 70 bis 71
- Abschnitt – Einfuhr und Ausfuhr
- §§ 72 bis 74
- Abschnitt – Informationsbeauftragter, Pharmaberater
- §§ 74a bis 76
- Abschnitt – Bestimmung der zuständigen Bundesoberbehörden und sonstige Bestimmungen
- §§ 77 bis 83a (§ 83b aufgehoben)
- Abschnitt – Haftung für Arzneimittelschäden
- §§ 84 bis 94a
- Abschnitt – Straf- und Bußgeldvorschriften
- §§ 95 bis 98 (§ 98a aufgehoben)
- Abschnitt – Überleitungs- und Übergangsvorschriften
- §§ 99 bis 148 (§ 149 aufgehoben)